
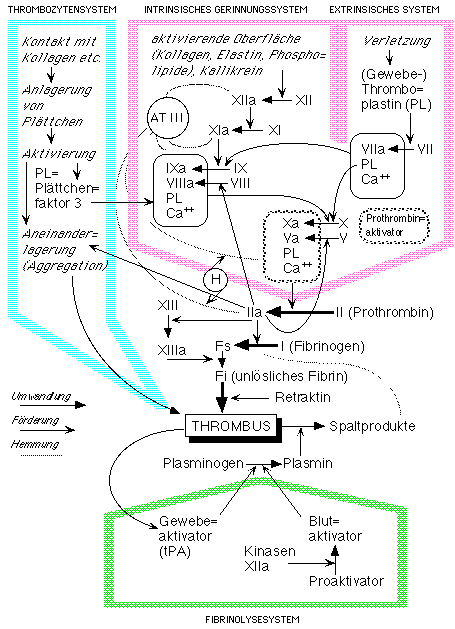
Blutgerinnung und Fibrinolyse
<Abbildung: Thrombozyten-,
Gerinnungs- und
Fibrinolysesystem
Aus: Praktische
Physiologie
I
= Fibrinogen
II = Prothrombin
V = (Pro)Akzelerin
VII = (Pro)Konvertin
VIII = antihämophiler Faktor A
IX = Christmas-Faktor (antihämophiler
Faktor B)
X = Stuart-Prower-Faktor
XI = PTA (Plasma-Thromboplastin-Antezedent)
XII = Hageman-Faktor
XIII = FSF (fibrinstabilisierender Faktor)
AT III = Antithrombin III
H = Heparin
Dicke Pfeile
betonen den zentralen Gerinnungsvorgang. Pfeilspitzen und Linien unterscheiden zwischen
Umwandlungvon Stoffen einerseits, positiven und negativen Einflüssenandererseits.
Blutstillung (Hämostase) tritt bei Verletzung der Gefäßwände auf, und es kommt zu
1) Zusammenziehung verletzter Gefäße (Vasokonstriktion ),
2) Aneinanderlagerung (Aggregation) und Verschmelzung von Thrombozyten,
3) Bildung eines Netzes aus Fibrinfäden durch die Blutgerinnung.
Diese Vorgänge werden in Sekunden (1,2) bis Minuten (3) wirksam,
verstärken sich gegenseitig und beenden den Blutaustritt aus der Wunde.
Später wachsen unter der Wirkung regelnder Signalstoffe (Zytokine) und
interzellulärer Kontaktmechanismen Zellen vor, decken die Wunde ab und
organisieren das Gewebe neu. Das Blutgerinnsel (Koagulum) wird durch
die Fibrinolyse wieder aufgelöst. Das Endergebnis ist eine Heilung der
Wunde, mit vollständiger Wiederherstellung des Gewebemusters oder unter
Hinterlassung einer Narbe.
Die Hauptmechanismen der Blutstillung sind eng miteinander verknüpft.
Sie werden als Gefäß-, Plättchen- und Gerinnungskomponente bezeichnet.
1) Beitrag der Blutgefäße:
Das Endothel trägt zur Gerinnung bei, indem es Faktoren für Gerinnung,
Fibrinolyse, Gerinnungshemmung sowie Anhaftungsmoleküle
(Adhäsivproteine) bildet. Unter der Wirkung von Bakteriengiften kann es
den Gerinnungsprozeß unterstützen, indem es Gewebefaktor freisetzt.
Unter normalen Umständen überwiegt die gerinnungs- und
thrombozytenhemmende sowie fibrinolysefördernde Aktivität des
Endothels.
Faktoren aus aktivierten Thrombozyten lösen eine Kontraktion glatter
Muskelzellen der Gefäßwand aus. Diese lokale Vasokonstriktion
(Reparatur-Ischämie) unterstützt die Blutstillung und Defektheilung.
Störungen der Gefäßfunktion (Angiopathien), wie sie infolge Vitamin
C-Mangel auftreten, äußern sich in einer Neigung zu punktförmigen
Blutungen (Petechien), die auch für Plättchenfunktionsstörungen
charakteristisch sind.
2) Beitrag der Thrombozyten:
Aktivierte Blutplättchen lagern sich an Wundstellen verletzter
Gefäßwände an und setzen Stoffe frei, die alle Komponenten der
Blutstillung unterstützen. Die normale Plättchenzahl beträgt
150.000-400.000 / µl Blut.
Rezeptoren in der Zellmembran der Blutplättchen werden durch Kollagen,
Thrombin, Adrenalin, Thromboxan, ADP u.a. aktiviert. Innerhalb von
Sekunden kommt es - über Thrombosthenin, ein kontraktiles Fasereiweiß
in den Plättchen - zu Änderung ihrer Gestalt, Freisetzung von gefäß-
und gerinnungsaktiven Substanzen aus ihren Granula und gegenseitiger
Verschmelzung mit Bildung eines gefäßabdichtenden Aggregats.
Bei Thrombopathien ist die Plättchenwirkung durch Funktionsstörungen
oder herabgesetzte Plättchenzahl herabgesetzt. Plättchenmangel
(Thrombopenie) führt zu spontaner Petechienbildung und verlängerter
Blutungszeit, wenn die Plättchenzahl auf etwa 30.000/µl gesunken ist.
Plättchen-Funktionsstörungen (Thrombasthenien) bewirken erhöhte
Blutungsbereitschaft und verminderte Thromboseneigung.
Verschiedene Pharmaka, wie Aspirin, schwächen die Plättchenfunktion;
Aspirin kann Gerinnselbildungen in den Gefäßen vorbeugen, auf
nüchternen Magen genommen allerdings auch Blutungen der
Magenschleimhaut auslösen.
3) Plasmatisches Gerinnungssystem:
Aktivierte Gerinnungs- und Plättchenfaktoren lassen aus Fibrinogen
aktives Fibrin entstehen. Dieses bildet ein labiles Netzwerk, das durch
den fibrinstabilisierenden Faktor und Retraktion (Zusammenziehung des
Gerinnsels) zu einem widerstandsfähigen Netz wird; dabei wird Serum
ausgepreßt. Der Gerinnungsmechanismus ist mehrfach abgesichert, sodaß
Blut normalerweise nicht gerinnt, bei Verletzungen jedoch innerhalb
weniger Minuten; sowohl Thrombosen als auch Blutungen können
lebensgefährlich sein.
Krankheiten, die durch erhöhte Blutungsneigung gekennzeichnet sind,
werden als hämorrhagische Diathesen bezeichnet, Gerinnungsstörungen als
Koagulopathien.
Die meisten Gerinnungsfaktoren werden mit römischen Ziffern bezeichnet,
ihre aktivierte Form mit “a” gekennzeichnet - z.B. F.II = Prothrombin,
F.IIa = Thrombin. Die Blutgerinnung beginnt mit der Aktivierung der
Vorphase, was auf zwei Wegen erfolgen kann: Durch das “intrinsische”
und “extrinsische” System:
• Das intrinsische (endogene, intravasale) System beginnt mit der
Aktivierung von Thrombozyten und Faktor XII (Hageman-Faktor) an
verletzten Gefäßen. Dann werden die Faktoren XI, IX und VIII aktiviert.
Faktor VIII wird unterstützt durch den Von-Willebrand-Faktor, ein
Kollagen-Anhaftungsprotein für Thrombozyten. Der Hageman-Faktor wirkt
auch im Fibrinolyse-, Komplement- und Kininsystem.
• Das extrinsische (exogene, extravasale) System wird bei Verletzung
durch freigesetzte Zellstrukturen (z.B. Golgi-Apparat) und Stoffe
(bezeichnet als Gewebefaktor, Gewebsthromboplastin, tissue factor)
aktiviert. Im extrinsischen System wirkt der Faktor VII (Prokonvertin).
Gendefekte können die normale Synthese von Gerinnungsfaktoren
verhindern. Bei der am häufigsten auftretenden Form, der Hämophilie A,
besteht ein Mangel an Faktor VIII; unzureichende Bildung des Faktors IX
bedingt die Hämophilie B. Schwere Hämophilieformen führen zu spontanen
Blutungen in Haut, Gelenke und lockeres Bindegewebe. Infusion von
Plasmafraktionen mit hohem Anteil an fehlenden Gerinnungsfaktoren
bremst die Blutungen. Ohne Behandlung können tödliche Komplikationen
auftreten.
Hämophilie wird geschlechtsgebunden vererbt: Sie von den Müttern
übertragen, tritt aber fast nur bei Männern auf. Der Grund ist, daß
sich die Gene der betreffenden Gerinnungsfaktoren auf dem
“Geschlechtschromosom” X, nicht aber Y, befinden. Frauen sind nur
bluterkrank, wenn beide X-Chromosomen defekte Gene enthalten (rezessive
Vererbung).
Die Systeme der Vorphase beeinflussen einander gegenseitig und münden
in einer gemeinsamen Endstrecke, in welche die Faktoren X
(Stuart-Faktor) und V (Proakzelerin) eingeschaltet sind. Zur Gerinnung
ist ferner die Anwesenheit freier (nicht gebundener) Kalziumionen (Ca++) notwendig.
Mehrere Hemmstoffe (Inhibitoren) beeinflussen die Gerinnung, z.B.
Antithrombin III und die Proteine C und S (durch Proteolyse der
Faktoren Va und VIIIa). Auch Abbauprodukte der Gerinnungs wirken
regulierend auf ihren Ablauf ein - sowohl verstärkend als auch dämpfend
(positive und negative Rückkopplung).
Die Vorphase produziert den Prothrombin-Aktivator, der Prothrombin
(Faktor II) in Thrombin umwandelt, welches wiederum Fibronogen (Faktor
I) zu Fibrin aktiviert. Thrombin aktiviert auch den
fibrinstabilisierenden Faktor (XIII), Thrombozyten, und seine eigene
Vorstufe. Das Fibringerinnsel wird durch Retraktin zum Thrombus
verfestigt, wobei sich die Fibrinfäden verkürzen.
Eine Thrombose liegt vor, wenn sich an den Gefäßwänden Zellaggregate
und Gerinnsel ausbilden. Diese engen den Blutstrom ein oder verlegen
das Gefäß. Thrombosierte Venen werden leicht entzündlich verändert
(Thrombophlebitis) und sind gut erkennbar, wenn sie oberflächlich
liegen. Tiefliegende Thrombosen (Oberschenkel-, Beckenvenen) können
szintigraphisch nachgewiesen werden (Injektion mit radioaktiv
markiertem Fibrin). Lösen sich Thromben ab, so werden sie mit dem
Blutstrom weitergetragen und embolisieren Gefäßaufzweigungen - venöse
Thromben in der Lunge, arterielle in stromabwärts gelegenen Organen.
Der Lungenkreislauf hat eine Filterfunktion: Thromben, Luftbläschen
(Injektion), Fettkügelchen (Knochenbruch) bleiben hier stecken
(Lungenembolie) und verhindern so eine arterielle Embolie. Größere
Thromben können massive parasympathische Reflexe auslösen, die im
Extremfall zu Herzstillstand führen.
Die Auflösung von Fibringerinnseln, die Fibrinolyse, erfolgt durch
Plasmin, welches durch Aktivatoren aus seiner Vorstufe Plasminogen
freigesetzt wird. Die Fibrinolyse ist stark durch das Endothel
beeinflußt. Die fibrinolytische Wirksamkeit von Venenblut ist je nach
Körpergebiet unterschiedlich.
Plasminogen wird aktiviert (Abb.) durch
• endothelialen Gewebeaktivator, der durch Bindung an Fibrin gezielt aktiviert wird,
• kontaktaktivierte Faktoren der endogenen Gerinnungs-Vorphase,
• Plasminogenaktivatoren aus Fibroblasten, Leukozyten und anderen Zellen.
• Urokinase in den Nierentubuli, die einer Gerinnung in den Harnwegen vorbeugt.
 © Helmut
Hinghofer-Szalkay
© Helmut
Hinghofer-Szalkay


 © Helmut
Hinghofer-Szalkay
© Helmut
Hinghofer-Szalkay